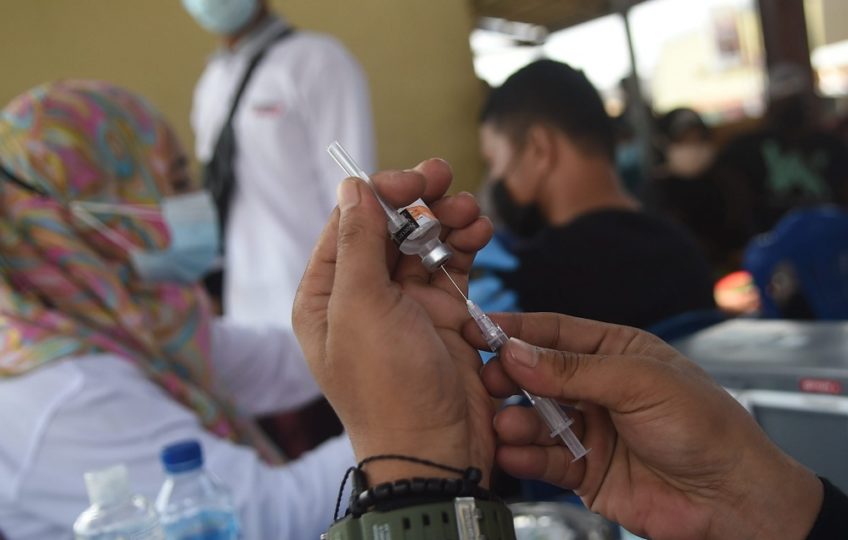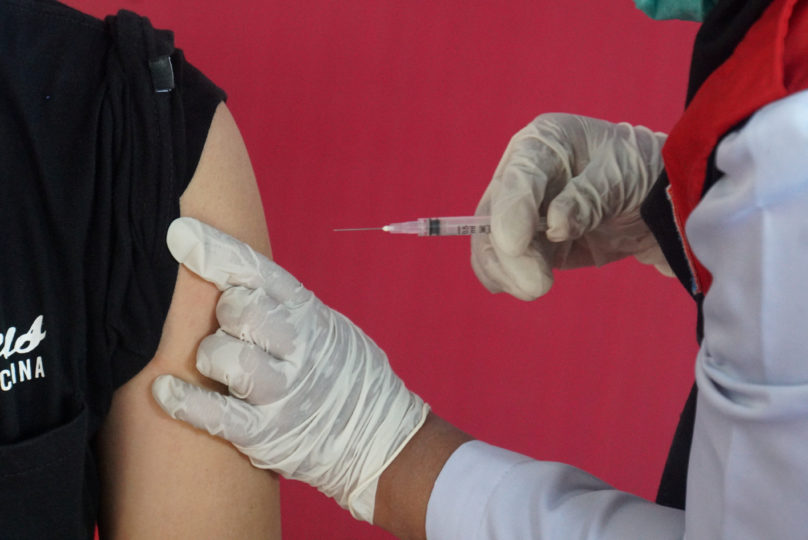
Kronologi | Vaksinasi Covid-19
Vaksin Pfizer: Vaksin Covid-19 Pertama yang Disetujui WHO
Kolaborasi Pfizer dan BioNTech membuahkan izin edar pertama vaksin Covid-19 yang dikeluarkan oleh WHO. Vaksin Pfizer-BioNTeh menunjukkan efikasi mencapai 95 persen bagi orang berusia 16 tahun ke atas, dan efikasi sebesar 100 persen pada kategori usia 12-15 tahun.