Poster | Vaksinasi Covid-19
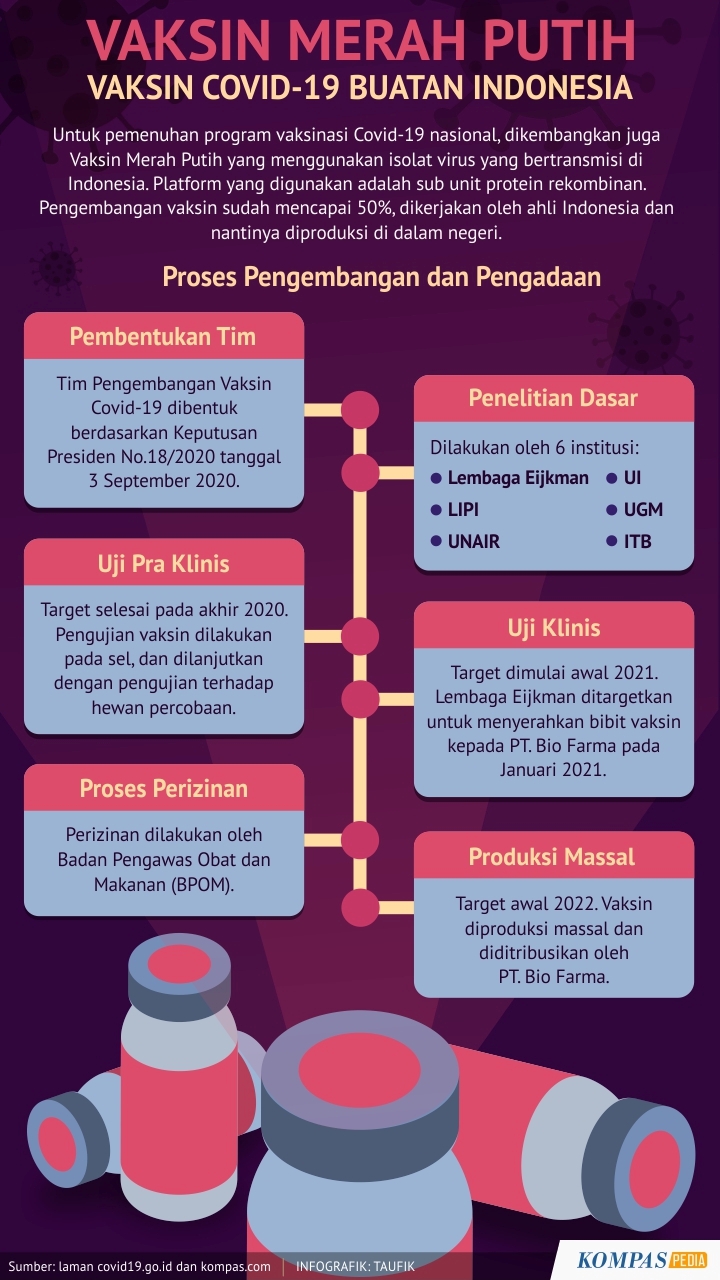
Vaksin Merah Putih, Vaksin Buatan Indonesia
Selain vaksin impor, produksi vaksin dalam negeri pun digiatkan untuk pemenuhan program nasional vaksinasi Covid-19. Beberapa survei menunjukkan harapan besar masyarakat terhadap kehadiran vaksin merah putih.

Guna mempercepat penanganan Covid-19 di Indonesia, pemerintah melalui Keputusan Presiden Nomor 18 Tahun 2020 tanggal 3 September [...]